Por DR. RAUL RIOS RITTER
“Hoy la innovación en salud ya no es solo tecnológica: es conceptual, informacional y cultural. Hemos transitado desde una medicina reactiva hacia una medicina predictiva, personalizada y participativa. La convergencia entre biología, ingeniería, inteligencia artificial y ciencias de la información redefine la noción misma de salud. Chile tiene la oportunidad histórica de no solo adoptar estas transformaciones, sino de convertirse en un laboratorio vivo de innovación biomédica responsable, integrativa y centrada en la persona.”
Prólogo
En honor al Dr. Ricardo Benjamín Maccioni. Toda obra que intenta pensar el futuro de la ciencia y de la medicina se construye inevitablemente sobre los cimientos de quienes, con lucidez y coraje intelectual, supieron anticipar los cambios antes de que estos se hicieran evidentes. “La Sociedad de la Innovación”, escrita por el Dr. Ricardo Benjamín Maccioni hace ya dos décadas, pertenece a ese tipo de textos fundacionales que no envejecen: no porque describan tecnologías específicas, sino porque revelan una forma de pensar, una actitud frente al conocimiento y una ética del desarrollo científico profundamente vigente.
El Dr. Maccioni no solo ha sido un referente internacional en neurociencia y biomedicina, sino también un pensador estratégico del rol que la ciencia debe cumplir en el destino de los países. Su obra y su trayectoria encarnan una convicción poco frecuente: que el desarrollo científico auténtico no se mide únicamente por índices de impacto o sofisticación tecnológica, sino por su capacidad de transformar la vida de las personas y contribuir al proyecto colectivo de una nación. En su mirada, la innovación no es un fin en sí misma, sino una responsabilidad histórica.
Este ensayo nace, en gran medida, inspirado por esa visión. Las reflexiones que aquí se presentan dialogan con las ideas que el Dr. Maccioni planteó tempranamente: la necesidad de pensar en grande, de trascender la fragmentación disciplinaria, de articular ciencia básica, clínica, tecnología y cultura, y de hacerlo siempre con una orientación clara hacia el bien común. En tiempos en que la velocidad del avance científico puede desbordar la reflexión ética y humanista, su pensamiento nos recuerda que el conocimiento requiere dirección, sentido y propósito.
Como maestro, el Dr. Maccioni ha ejercido una influencia que va más allá de la transmisión de saberes. Ha enseñado, con el ejemplo, que la excelencia científica es inseparable del rigor intelectual, la honestidad epistemológica y la generosidad formativa. Su permanente llamado a “pensar en grande” no es una invitación a la grandilocuencia, sino a la responsabilidad de no reducir la ciencia a lo inmediato, de no conformarse con soluciones menores cuando el país y la humanidad requieren visiones de largo aliento.
Pero quizás uno de los rasgos más distintivos de su legado es el profundo amor que profesa por Chile y por su destino. Aun desde escenarios internacionales de alto nivel, su pensamiento ha estado siempre anclado en la convicción de que este país posee el talento, la creatividad y la dignidad intelectual necesarias para aportar al conocimiento global. Esa confianza, sostenida en décadas de trabajo, es en sí misma una forma de liderazgo científico y moral.
Este prólogo no pretende ser un homenaje retórico, sino un acto de reconocimiento intelectual y humano. Las páginas que siguen aspiran a honrar ese legado, no imitándolo, sino continuando el impulso que lo anima: contribuir, desde la ciencia y la medicina, a la construcción de un futuro más lúcido, más justo y más humano. Si este ensayo logra abrir preguntas, provocar reflexión o inspirar nuevas acciones, será en buena medida porque se inscribe en la tradición de pensamiento que el Dr. Ricardo Benjamín Maccioni ha ayudado a forjar.
Introducción
Hace poco más de dos décadas, cuando se escribió “La Sociedad de la Innovación”, por el neurocientífico chileno nominado al premio Nobel de Medicina Dr. Ricardo Benjamin Maccioni, el mundo comenzaba a vislumbrar una transformación profunda impulsada por la ciencia y la tecnología. En ese entonces, el concepto de innovación estaba aún estrechamente ligado al desarrollo industrial, a la ingeniería productiva y a la transferencia tecnológica clásica. En el ámbito de la salud, la innovación avanzaba con paso firme, pero todavía fragmentada: nuevos fármacos, mejores técnicas quirúrgicas, diagnósticos más precisos. Sin embargo, no era evidente que se estaba gestando un cambio de paradigma mucho más profundo.
Hoy, a más de veinte años de distancia, la innovación biomédica ha dejado de ser incremental para convertirse en disruptiva, convergente y sistémica. La medicina contemporánea ya no se limita a tratar enfermedades, sino que busca comprender, anticipar y modular los procesos biológicos que determinan la salud y la enfermedad. Este tránsito ha sido posible gracias a la integración de la biología molecular, la inmunología, la ingeniería, la informática, la inteligencia artificial y, más recientemente, las ciencias de la información y la biofísica.
Este ensayo revisa los principales impactos de la innovación biomédica y en salud global ocurridos en los últimos quince años, analiza su significado conceptual y práctico, y propone una reflexión estratégica sobre las oportunidades que estos avances ofrecen para países como Chile.
1.- De la ciencia básica a la ciencia traslacional: un cambio irreversible. Uno de los cambios más profundos y estructurales en la biomedicina contemporánea ha sido el tránsito desde una ciencia predominantemente básica y descriptiva hacia una ciencia traslacional orientada al impacto clínico, un proceso que se ha vuelto irreversible en las últimas dos décadas.
Tradicionalmente, la investigación biomédica avanzaba de manera lineal: los descubrimientos fundamentales permanecían durante años —o incluso décadas— confinados al laboratorio, sin un puente claro hacia la práctica clínica. Hoy, ese paradigma ha sido reemplazado por un modelo dinámico, bidireccional y colaborativo, donde el conocimiento fluye constantemente entre el laboratorio, el hospital y la población.
Un ejemplo emblemático de esta transformación se observa en la oncología molecular. El descubrimiento de mutaciones específicas en genes como BRAF, EGFR o ALK, inicialmente fruto de investigación básica en biología celular y genética, dio origen en pocos años a terapias dirigidas que han cambiado radicalmente el pronóstico de subgrupos de pacientes con cáncer de pulmón, melanoma o cáncer colorrectal. Este paso acelerado desde el gen al fármaco, y desde el fármaco al paciente, ilustra con claridad la esencia de la medicina traslacional: comprender el mecanismo íntimo de la enfermedad para intervenirlo de forma precisa.
Otro ejemplo paradigmático es el desarrollo de las vacunas de ARN mensajero. Durante décadas, el estudio del ARN fue considerado un campo eminentemente básico, de interés académico más que clínico. Sin embargo, la comprensión de la biología del ARN, su estabilidad, su traducción y su interacción con el sistema inmune permitió que, frente a la pandemia por SARS-CoV-2, ese conocimiento se tradujera en vacunas eficaces en un tiempo sin precedentes. Este hito no solo salvó millones de vidas, sino que demostró que la inversión sostenida en ciencia básica es indispensable para respuestas traslacionales rápidas cuando la sociedad lo requiere.
En el ámbito de la neurociencia, la ciencia traslacional ha permitido conectar hipótesis moleculares con aplicaciones clínicas concretas. La caracterización de proteínas mal plegadas como la tau y la beta-amiloide en la enfermedad de Alzheimer, inicialmente descritas en modelos celulares y animales, condujo al desarrollo de biomarcadores diagnósticos (PET cerebral, análisis de LCR y plasma) y a ensayos clínicos dirigidos a etapas tempranas de la enfermedad. Aunque los desafíos terapéuticos persisten, este enfoque ha transformado el Alzheimer de una entidad clínicamente definida a una enfermedad biológica detectable décadas antes de los síntomas, abriendo un espacio real para la prevención.
La inmunología traslacional ofrece quizás uno de los ejemplos más notables del nuevo paradigma. El entendimiento básico de la activación de linfocitos T, la presentación antigénica y los mecanismos de evasión tumoral permitió el desarrollo de las terapias CAR-T y de los inhibidores de puntos de control inmunológico. Estos tratamientos, que hoy se aplican en pacientes con leucemias, linfomas y tumores sólidos, nacieron directamente de preguntas fundamentales sobre cómo el sistema inmune reconoce —o deja de reconocer— lo propio y lo extraño. La frontera entre investigación básica e intervención clínica se volvió, en este contexto, prácticamente indistinguible.
Asimismo, la medicina traslacional ha redefinido el campo de la medicina regenerativa. El estudio de las propiedades de las células madre, su diferenciación y su interacción con el microambiente tisular evolucionó hacia aplicaciones clínicas que ya no buscan únicamente reemplazar tejido dañado, sino modular la inflamación, restaurar la señalización celular y reactivar procesos endógenos de reparación. El uso de células mesenquimales, exosomas y factores bioactivos ilustra cómo conceptos inicialmente biológicos se convierten en herramientas terapéuticas complejas y personalizadas.
Un elemento clave de esta transición ha sido la emergencia de centros de investigación clínica integrados, donde científicos básicos, médicos, ingenieros y bioinformáticos trabajan de manera conjunta. En este ecosistema, el paciente deja de ser un receptor pasivo del conocimiento y se convierte en parte activa del proceso de innovación. Ensayos clínicos adaptativos, biobancos, plataformas de datos y colaboración público-privada son hoy componentes esenciales de la ciencia traslacional moderna.
Para países como Chile, este cambio representa una oportunidad estratégica. La ciencia traslacional permite generar impacto sin requerir necesariamente grandes volúmenes de infraestructura industrial, sino apostando por talento humano, colaboración internacional y visión integradora. Al reducir la distancia entre descubrimiento y aplicación, se favorece una medicina más pertinente, eficiente y alineada con las necesidades reales de la población.
En este sentido, la ciencia traslacional no es solo una metodología, sino una nueva forma de entender la responsabilidad social de la ciencia. Un cambio irreversible que redefine el rol del investigador, del clínico y de las instituciones, y que posiciona a la innovación biomédica como un motor legítimo de desarrollo humano, sanitario y cultural.
Para países en desarrollo científico como Chile, la medicina traslacional representa una oportunidad estratégica: permite integrar investigación, clínica y tecnología sin necesidad de competir en volumen con las grandes potencias, sino apostando por nichos de excelencia, colaboración internacional y transferencia inteligente del conocimiento.
2.- La revolución de la medicina de precisión
La medicina de precisión representa uno de los giros paradigmáticos más relevantes de la biomedicina contemporánea. En contraste con el modelo tradicional, basado en protocolos estandarizados y tratamientos “promedio”, la medicina de precisión parte del reconocimiento de que cada individuo es biológicamente único, y que esa singularidad determina tanto la susceptibilidad a la enfermedad como la respuesta a las intervenciones terapéuticas. Esta revolución ha sido posible gracias a la convergencia de la genómica, la biología molecular, la bioinformática y el análisis avanzado de datos, que en los últimos quince años han transformado de manera irreversible la práctica clínica.
Uno de los pilares fundacionales de la medicina de precisión ha sido la secuenciación genómica de nueva generación (NGS). La reducción exponencial de los costos y tiempos de secuenciación permitió pasar del Proyecto Genoma Humano —un esfuerzo monumental y centralizado— a la posibilidad de secuenciar genomas individuales como parte de la práctica clínica. En oncología, este avance ha permitido identificar mutaciones conductoras específicas (driver mutations) responsables del crecimiento tumoral, dando lugar a terapias dirigidas altamente eficaces. El uso de inhibidores de EGFR en cáncer de pulmón no microcítico, de BRAF en melanoma o de HER2 en cáncer de mama ejemplifica cómo el conocimiento molecular redefine diagnósticos que antes se consideraban clínicamente homogéneos.
Este enfoque ha tenido un impacto profundo no solo en la eficacia terapéutica, sino también en la seguridad del paciente. La farmacogenómica, rama central de la medicina de precisión, ha demostrado que variantes genéticas individuales influyen de manera significativa en el metabolismo de los fármacos, su eficacia y su toxicidad. Ejemplos ampliamente validados incluyen la dosificación personalizada de anticoagulantes como la warfarina, la predicción de reacciones adversas a quimioterapias como el 5-fluorouracilo o la selección de antidepresivos basada en polimorfismos de enzimas del citocromo P450. Estas aplicaciones han transformado la prescripción médica en un acto más racional, predictivo y seguro.
Más allá del genoma, la medicina de precisión ha incorporado progresivamente un enfoque multi-ómico, integrando información del transcriptoma, proteoma, metaboloma y microbioma. Este abordaje sistémico ha permitido comprender que la enfermedad no es el resultado de una sola alteración genética, sino de redes biológicas complejas y dinámicas. En enfermedades metabólicas y autoinmunes, por ejemplo, el análisis del microbioma intestinal ha revelado su rol como modulador clave de la inflamación, la inmunidad y el metabolismo energético, abriendo nuevas estrategias terapéuticas basadas en intervenciones personalizadas sobre la microbiota.
En el campo de la neurología y las enfermedades neurodegenerativas, la medicina de precisión ha comenzado a modificar de manera sustantiva los criterios diagnósticos. La enfermedad de Alzheimer, tradicionalmente diagnosticada en etapas clínicas avanzadas, hoy puede caracterizarse biológicamente mediante biomarcadores específicos de beta-amiloide y proteína tau, tanto en líquido cefalorraquídeo como en plasma. Esta capacidad de identificar la patología en fases preclínicas ha permitido diseñar ensayos clínicos más precisos, seleccionar poblaciones homogéneas y avanzar hacia estrategias preventivas personalizadas, un cambio conceptual profundo respecto del enfoque paliativo clásico.
Otro avance significativo es el desarrollo de scores de riesgo poligénico (PRS), que integran la contribución de múltiples variantes genéticas para estimar el riesgo individual de desarrollar determinadas enfermedades crónicas, como cardiopatías, diabetes tipo 2 o ciertos tipos de cáncer. Aunque estos modelos aún se encuentran en evolución, su potencial reside en permitir intervenciones tempranas dirigidas a individuos de alto riesgo, desplazando el foco desde el tratamiento tardío hacia la prevención personalizada.
La medicina de precisión ha encontrado además un potente aliado en la inteligencia artificial, que permite integrar y analizar volúmenes masivos de datos clínicos y moleculares imposibles de manejar mediante métodos tradicionales. Algoritmos de aprendizaje automático ya se utilizan para identificar patrones ocultos en imágenes médicas, predecir la progresión de enfermedades y optimizar decisiones terapéuticas. En este contexto, el concepto de gemelo digital del paciente —un modelo computacional que simula la biología individual— comienza a perfilarse como una herramienta central para la medicina del futuro.
Para países como Chile, la revolución de la medicina de precisión plantea desafíos y oportunidades. Su implementación requiere infraestructura tecnológica, formación especializada y marcos regulatorios adecuados, pero no necesariamente una escala industrial masiva. La posibilidad de desarrollar centros de referencia en medicina de precisión, integrados a redes internacionales y orientados a patologías prioritarias, representa una estrategia realista y de alto impacto. Más aún, la medicina de precisión ofrece una vía concreta para transitar desde sistemas de salud reactivos hacia modelos predictivos, preventivos y participativos, alineados con las necesidades demográficas y epidemiológicas del país.
En síntesis, la medicina de precisión no constituye simplemente un conjunto de nuevas herramientas diagnósticas o terapéuticas, sino un cambio profundo en la forma de concebir la medicina. Al reconocer la singularidad biológica de cada individuo, redefine el acto médico, fortalece la relación clínica y sitúa al paciente en el centro de un sistema de salud más inteligente, humano y eficaz.
3.- Inmunoterapia y terapias celulares: reeducar al sistema inmune. La irrupción de la inmunoterapia y de las terapias celulares avanzadas constituye, sin exageración, uno de los cambios de paradigma más profundos en la historia reciente de la biomedicina. Durante gran parte del siglo XX, el sistema inmune fue concebido principalmente como un mecanismo defensivo, reactivo y relativamente inespecífico. Hoy, gracias a décadas de investigación en inmunología básica y traslacional, se reconoce como un sistema regulador central, capaz de decidir el destino de procesos tan complejos como la inflamación crónica, la regeneración tisular, la vigilancia tumoral y la tolerancia inmunológica.
Uno de los hitos fundamentales de esta revolución ha sido la comprensión de que muchas enfermedades —en particular el cáncer— no progresan únicamente por alteraciones genéticas intrínsecas de las células, sino por fallas en la vigilancia y regulación inmunológica. El tumor ya no se entiende solo como una masa celular aberrante, sino como un ecosistema biológico capaz de educar, desviar o suprimir al sistema inmune. Esta visión permitió el desarrollo de terapias dirigidas a restaurar la capacidad del organismo para reconocer y controlar la enfermedad.
Un ejemplo paradigmático de esta reeducación inmune son los inhibidores de puntos de control inmunológico (checkpoint inhibitors). El descubrimiento de moléculas como CTLA-4, PD-1 y PD-L1 —resultado de investigación básica en activación y anergia linfocitaria— condujo al desarrollo de anticuerpos monoclonales capaces de liberar los “frenos” del sistema inmune. Su aplicación clínica ha transformado el pronóstico de múltiples tumores, incluyendo melanoma, cáncer de pulmón y carcinoma renal, demostrando que el sistema inmune, correctamente modulado, puede ejercer un control duradero de la enfermedad.
En paralelo, las terapias celulares adoptivas, particularmente las células CAR-T, han llevado el concepto de inmunoterapia a un nivel sin precedentes. Mediante la ingeniería genética de linfocitos T autólogos para expresar receptores quiméricos específicos, se ha logrado inducir remisiones profundas en leucemias y linfomas refractarios a tratamientos convencionales. Este enfoque representa una forma extrema de medicina personalizada, donde cada tratamiento es diseñado a partir de las propias células del paciente, reprogramadas para reconocer antígenos tumorales específicos.
Sin embargo, la verdadera madurez conceptual de la inmunoterapia no reside únicamente en la potencia citotóxica de estas estrategias, sino en la comprensión de que el objetivo último es restaurar la coherencia y la inteligencia del sistema inmune, más que imponer una agresión externa. En este contexto, la inmunoterapia comienza a converger con la medicina regenerativa y con enfoques que buscan modular la inflamación, el microambiente tisular y la comunicación intercelular.
Aquí adquiere especial relevancia la vacuna de células dendríticas, una de las expresiones más elegantes y fisiológicamente coherentes de la inmunoterapia moderna. Las células dendríticas ocupan un rol central como puente entre la inmunidad innata y adaptativa, siendo las principales responsables de capturar, procesar y presentar antígenos al sistema inmune, determinando si la respuesta será de activación, tolerancia o anergia. Su utilización terapéutica se basa en un principio fundamental: enseñar al sistema inmune a reconocer la enfermedad de manera específica y duradera.
La vacuna de células dendríticas no busca destruir directamente las células tumorales, sino reeducar al sistema inmune del paciente, entrenándolo para identificar antígenos relevantes y generar una respuesta coordinada y sostenida en el tiempo. A diferencia de otras inmunoterapias más agresivas, este enfoque se apoya en los mecanismos fisiológicos naturales de presentación antigénica y memoria inmunológica. Estudios clínicos han demostrado su seguridad y su capacidad para inducir respuestas inmunes específicas en distintos tipos de cáncer, así como en enfermedades neurodegenerativas, donde la modulación inmune emerge como una estrategia terapéutica prometedora.
Desde una perspectiva traslacional, la vacuna de células dendríticas representa un modelo particularmente atractivo para sistemas de salud que buscan innovación personalizada, ética y escalable. Su carácter autólogo, su perfil de seguridad favorable y su potencial de combinación con otras terapias —como inmunomoduladores, terapias metabólicas o medicina regenerativa— la posicionan como una plataforma versátil dentro del arsenal terapéutico moderno. Más aún, simboliza un cambio filosófico profundo: pasar de combatir la enfermedad a activar la capacidad intrínseca del organismo para restaurar el equilibrio.
Las terapias celulares inmunomoduladoras, incluyendo el uso de células mesenquimales con propiedades antiinflamatorias y reguladoras, refuerzan esta visión integradora. Lejos de actuar como simples “reemplazos celulares”, estas terapias funcionan como orquestadores del microambiente, modulando citoquinas, células inmunes residentes y procesos de reparación tisular. En conjunto, inmunoterapia y medicina regenerativa convergen hacia un nuevo paradigma terapéutico centrado en la regulación sistémica.
Para países como Chile, este campo representa una oportunidad estratégica de alto impacto. La inmunoterapia personalizada, y en particular las vacunas de células dendríticas, permiten desarrollar innovación clínica avanzada sin depender exclusivamente de grandes plataformas farmacéuticas, favoreciendo modelos de investigación clínica local, producción controlada y colaboración académica. Más importante aún, ofrecen una vía para situar al paciente en el centro de un proceso terapéutico activo, consciente y participativo.
En síntesis, la inmunoterapia y las terapias celulares no solo han ampliado el arsenal terapéutico de la medicina moderna, sino que han redefinido su filosofía. Al reeducar al sistema inmune, la medicina contemporánea comienza a reconocer que la curación no proviene únicamente de intervenciones externas, sino de la capacidad del propio organismo para recuperar su inteligencia biológica. En este sentido, la vacuna de células dendríticas no es solo una tecnología terapéutica, sino un símbolo del nuevo paradigma médico que emerge en el siglo XXI.
Paralelamente, la medicina regenerativa ha experimentado una transformación profunda, pasando desde un uso inicial, en muchos casos empírico, de las células madre hacia enfoques cada vez más sofisticados, racionales y basados en mecanismos biológicos bien caracterizados. Hoy, la medicina regenerativa ya no se limita a la idea de reemplazar células dañadas, sino que persigue un objetivo más ambicioso y conceptualmente avanzado: restaurar la información biológica, el microambiente tisular y las señales que permiten a los tejidos recuperar su capacidad intrínseca de autorregulación y reparación.
Dentro de este marco, las células madre mesenquimales (MSC), y en particular aquellas derivadas de cordón umbilical, han adquirido un rol central. Inicialmente valoradas por su capacidad de diferenciación limitada, hoy se reconoce que su principal efecto terapéutico reside en su potente acción paracrina e inmunomoduladora. Las MSC de cordón umbilical destacan por su elevada capacidad proliferativa, su bajo potencial inmunogénico y su perfil antiinflamatorio, características que las convierten en herramientas especialmente atractivas para aplicaciones clínicas en enfermedades inflamatorias crónicas, autoinmunes, degenerativas y oncológicas. Su acción sobre el microambiente tisular —modulando citoquinas, células inmunes residentes y procesos de angiogénesis y reparación— ilustra claramente el cambio de paradigma desde la sustitución celular hacia la regulación sistémica del tejido enfermo.
Este enfoque ha sido reforzado por el creciente interés en los exosomas y vesículas extracelulares, derivados en muchos casos de células mesenquimales, que actúan como verdaderos portadores de información biológica. Estas nanoestructuras contienen microARN, proteínas y factores bioactivos capaces de modificar la conducta de las células receptoras, amplificando los efectos terapéuticos sin necesidad de la integración celular directa. La utilización de exosomas representa un paso más en la comprensión de la regeneración como un fenómeno informacional, más que meramente estructural.
Sin embargo, uno de los avances más trascendentales de la medicina regenerativa contemporánea ha sido la aparición de las células pluripotentes inducidas (iPSC), un hito científico que redefinió por completo los límites del campo. El descubrimiento realizado por el Dr. Shinya Yamanaka, al demostrar que células somáticas adultas —como fibroblastos de la piel— podían ser reprogramadas mediante un conjunto específico de factores de transcripción para recuperar un estado pluripotente similar al de las células embrionarias, marcó un antes y un después en la biología moderna. Este logro, reconocido con el Premio Nobel de Medicina, no solo resolvió gran parte de las controversias éticas asociadas al uso de células embrionarias, sino que abrió una nueva era en la medicina personalizada.
Las iPSC poseen la capacidad de diferenciarse en prácticamente cualquier tipo celular del organismo, lo que las convierte en una plataforma de enorme potencial para la regeneración tisular, la modelización de enfermedades y el desarrollo de terapias personalizadas. Más aún, su obtención a partir de células del propio paciente permite imaginar escenarios terapéuticos donde la regeneración se realiza sin riesgo de rechazo inmunológico. En investigación biomédica, las iPSC ya se utilizan para generar organoides humanos, modelos tridimensionales que replican con notable fidelidad la arquitectura y función de órganos como el cerebro, el corazón o el hígado, permitiendo estudiar enfermedades humanas de manera directa y probar intervenciones terapéuticas con un grado de precisión sin precedentes.
Desde una perspectiva conceptual, las iPSC representan la máxima expresión de la medicina regenerativa como medicina de la información. Al reprogramar una célula adulta, no se modifica su estructura genética, sino que se reactiva un programa de desarrollo latente, demostrando que la identidad celular no es fija, sino dinámica y dependiente del contexto informacional. Este principio refuerza la idea de que muchas patologías podrían abordarse no solo corrigiendo daños, sino reordenando los programas biológicos que regulan la función tisular.
En conjunto, la evolución de la medicina regenerativa —desde las células mesenquimales de cordón umbilical hasta las iPSC— refleja una transición conceptual profunda: de la reparación estructural a la restauración de la coherencia biológica. Para países como Chile, este campo ofrece una oportunidad estratégica excepcional, al permitir el desarrollo de terapias avanzadas, investigación traslacional y plataformas de innovación clínica con alto valor agregado. Más aún, plantea la posibilidad de posicionar la medicina regenerativa no solo como una especialidad terapéutica, sino como un nuevo lenguaje médico, capaz de integrar biología, información y propósito en la búsqueda de la salud.
Organoides: modelos tridimensionales que redefinen la biomedicina. En la intersección entre la biología del desarrollo, la medicina regenerativa y la ingeniería tisular, los organoides han emergido como uno de los avances más disruptivos de la última década. Se trata de estructuras tridimensionales derivadas de células pluripotentes, capaces de autoorganizarse en cultivos in vitro y replicar con notable fidelidad la arquitectura y función de órganos humanos. Esta capacidad transformadora ha cambiado la forma en que estudiamos el desarrollo embrionario, la fisiopatología de enfermedades complejas y la respuesta a fármacos, superando las limitaciones de modelos monolayer tradicionales y muchos modelos animales.
Los organoides combinan la plasticidad biológica de las células pluripotentes con condiciones de cultivo que recapitulan aspectos clave del microambiente tisular. Por ejemplo, los organoides cerebrales pueden desarrollar capas corticales y circuitos neuronales rudimentarios que permiten estudiar eventos del neurodesarrollo y patologías como el Alzheimer o las epilepsias de origen genético en un contexto humano, sin las barreras éticas y biológicas que implican los estudios in vivo. Asimismo, organoides intestinales, hepáticos o pulmonares han demostrado ser herramientas excepcionales para modelar enfermedades metabólicas, infecciones virales y respuestas a terapias farmacológicas, ofreciendo una plataforma preclínica altamente predictiva para la traslación clínica.
En este campo, la plataforma Karolinska Stem Cell Organoids (KISCO) del Karolinska Institutet representa una contribución significativa y estratégica a nivel mundial. Dirigida científicamente por el Dr. José Inzunza, KISCO opera como un núcleo especializado en el uso de células pluripotentes —humanas embrionarias (hESC) y células pluripotentes inducidas (hiPSC)— para la generación de organoides específicos que reflejan de manera realista el comportamiento de tejidos humanos. Su misión central es potenciar el estudio de mecanismos biológicos complejos de enfermedades humanas utilizando modelos tridimensionales que se asemejan al tejido in vivo, facilitando así investigaciones que van desde la biología del desarrollo hasta la farmacología translacional.
El trabajo del Dr. Inzunza posee raíces profundas en la biología celular y reproductiva, con experiencia en técnicas avanzadas de micromanipulación embrionaria y en la derivación y caracterización de líneas de hESC, lo que ha sido crucial para el desarrollo de organoides robustos y reproducibles. Su enfoque actual abarca la creación y uso de organoides derivados de células pluripotentes para modelar enfermedades y evaluar la toxicidad de fármacos, acercando la investigación básica al terreno clínico con un nivel de precisión sin precedentes.
La plataforma KISCO no solo provee servicios de generación y caracterización de organoides de múltiples linajes —incluyendo modelos de cerebro, pulmón, hígado, intestino y hueso— sino que también incorpora técnicas avanzadas como la edición génica (CRISPR/Cas9) para crear modelos genéticos específicos y la adaptación de condiciones de cultivo libres de componentes animales, lo que facilita su aplicación en estudios que demandan alta relevancia clínica.
Un ejemplo concreto del impacto de los organoides en biomedicina es su uso en el estudio de enfermedades neurodegenerativas. Proyectos recientes han utilizado organoides cerebrales para investigar procesos fundamentales de la enfermedad de Alzheimer, permitiendo observar en términos tridimensionales cómo mutaciones específicas alteran la diferenciación neuronal, la formación de sinapsis y la acumulación de proteínas patológicas. Este tipo de modelos han demostrado ser superiores a los tradicionales en muchos aspectos, ya que conservan interacciones celulares y patrones de desarrollo propios del sistema nervioso humano.
Los organoides también han impulsado avances en medicina personalizada. Organoides derivados de células de pacientes con cáncer o enfermedades raras permiten probar terapias específicas ex vivo antes de administrarlas clínicamente, lo que reduce riesgos y optimiza los regímenes terapéuticos. Asimismo, se emplean en el desarrollo de terapias celulares avanzadas y en la evaluación de la respuesta inmunológica a nuevos fármacos, integrando datos genéticos, epigenéticos y funcionales de manera simultánea.
Más allá de su valor como modelos experimentales, los organoides están acelerando la descodificación de la biología humana en condiciones de salud y enfermedad, al tiempo que aportan una herramienta indispensable para el diseño racional de nuevas terapias. Su capacidad para capturar la complejidad tisular en un entorno controlado los posiciona como una tecnología esencial para la medicina del siglo XXI, en la que la precisión diagnóstica y terapéutica exige modelos biológicos que no solo describan fenómenos, sino que predigan con fidelidad la respuesta del organismo real.
Para países como Chile, la integración de plataformas similares a KISCO puede significar un salto cualitativo en la investigación biomédica local. La posibilidad de desarrollar modelos de organoides propios —alineados con prioridades sanitarias nacionales— permitiría abordar enfermedades prevalentes con herramientas de vanguardia, fortalecer la formación de investigadores y facilitar la colaboración internacional en proyectos de alto impacto.
4.- Inteligencia artificial y salud digital: una nueva arquitectura del cuidado
Desde aproximadamente 2015, la irrupción de la inteligencia artificial (IA) ha modificado de manera profunda la práctica médica. Algoritmos capaces de analizar grandes volúmenes de datos clínicos, imágenes médicas y señales fisiológicas han alcanzado niveles de desempeño comparables —y en algunos casos superiores— a expertos humanos.
La incorporación de la inteligencia artificial (IA) y de las tecnologías de salud digital ha introducido una transformación estructural en la biomedicina contemporánea, comparable —por su alcance— a la irrupción de los antibióticos o de la imagenología moderna. No se trata simplemente de automatizar tareas existentes, sino de reconfigurar la arquitectura misma del cuidado, modificando la forma en que se diagnostica, se decide, se trata y se acompaña a los pacientes a lo largo del tiempo.
Recuadro comparativo
Medicina clásica vs. Medicina asistida por Inteligencia Artificial
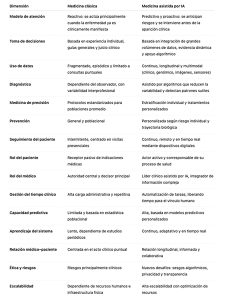
Uno de los primeros ámbitos donde la IA demostró su potencial fue el diagnóstico por imágenes. Algoritmos de aprendizaje profundo entrenados con millones de imágenes han alcanzado niveles de precisión equivalentes o superiores a especialistas humanos en áreas como radiología, dermatología y anatomía patológica. En oncología, por ejemplo, sistemas de IA son capaces de detectar lesiones pulmonares, mamarias o cerebrales en estadios más tempranos que los métodos convencionales, reduciendo la variabilidad interobservador y mejorando la detección precoz. En patología digital, la IA permite identificar patrones histológicos sutiles, cuantificar biomarcadores y correlacionarlos con pronóstico y respuesta terapéutica, integrando información que antes permanecía fragmentada.
Más allá del diagnóstico, la IA ha comenzado a transformar la toma de decisiones clínicas. Modelos predictivos entrenados con grandes bases de datos clínicos pueden estimar riesgos de complicaciones, progresión de enfermedades o reingresos hospitalarios, permitiendo una medicina más anticipatoria. En unidades de cuidados intensivos, por ejemplo, algoritmos de IA se utilizan para predecir sepsis horas antes de que se manifieste clínicamente, ofreciendo una ventana crítica para la intervención temprana. En cardiología, modelos basados en electrocardiogramas y datos longitudinales permiten identificar pacientes con alto riesgo de fibrilación auricular o muerte súbita antes de que ocurra el evento.
La convergencia entre IA y medicina de precisión ha amplificado aún más su impacto. La capacidad de integrar datos genómicos, transcriptómicos, metabolómicos e imágenes clínicas ha dado lugar a sistemas que no solo describen la enfermedad, sino que predicen la respuesta individual a distintos tratamientos. En oncología, la IA se utiliza para seleccionar terapias dirigidas, optimizar esquemas de combinación y estratificar pacientes en ensayos clínicos, aumentando la probabilidad de éxito terapéutico y reduciendo la exposición a tratamientos ineficaces.
Un concepto emergente particularmente relevante es el del gemelo digital del paciente. Este enfoque consiste en construir un modelo computacional dinámico que represente la biología individual de una persona, integrando datos clínicos, moleculares, fisiológicos y conductuales. El gemelo digital permite simular escenarios terapéuticos, anticipar efectos adversos y ajustar tratamientos de manera personalizada antes de aplicarlos en la práctica real. Aunque aún en desarrollo, este paradigma representa un salto cualitativo hacia una medicina verdaderamente predictiva y personalizada.
Paralelamente, la salud digital ha desplazado el eje del cuidado desde el hospital hacia el entorno cotidiano del paciente. Dispositivos portátiles, sensores biomédicos y aplicaciones móviles permiten monitorear en tiempo real parámetros como ritmo cardíaco, actividad física, sueño, glucosa o variabilidad de la frecuencia cardíaca. Estos datos, analizados mediante IA, transforman al paciente en una fuente continua de información clínica, posibilitando intervenciones tempranas y personalizadas. En enfermedades crónicas como la diabetes, la insuficiencia cardíaca o las patologías respiratorias, este enfoque ha demostrado reducir hospitalizaciones y mejorar la adherencia terapéutica.
La pandemia por COVID-19 aceleró de manera decisiva la adopción de telemedicina avanzada, integrando consultas virtuales, monitoreo remoto y seguimiento longitudinal. Lejos de ser una solución transitoria, la telemedicina se ha consolidado como un componente estructural del sistema de salud moderno, especialmente relevante para territorios extensos o con acceso limitado a especialistas. En este contexto, la IA actúa como un copiloto clínico, asistiendo al profesional en la interpretación de datos, la priorización de casos y la toma de decisiones.
Desde una perspectiva poblacional, la IA ha revolucionado la salud pública y la epidemiología. El análisis de grandes volúmenes de datos permite identificar patrones de enfermedad, evaluar intervenciones sanitarias y anticipar brotes epidemiológicos con mayor precisión. La integración de datos clínicos, ambientales y sociales ha dado lugar a modelos que reconocen el peso de los determinantes sociales de la salud, ampliando la mirada biomédica hacia una comprensión más integral del bienestar humano.
No obstante, esta nueva arquitectura del cuidado plantea desafíos éticos, regulatorios y culturales significativos. La transparencia de los algoritmos, la protección de los datos personales, la equidad en el acceso y la formación adecuada de los profesionales de la salud son condiciones indispensables para que la IA se convierta en una herramienta de empoderamiento y no de exclusión. La inteligencia artificial no reemplaza al médico, pero transforma radicalmente su rol, exigiendo nuevas competencias y una relación más horizontal con el paciente.
Para países como Chile, la inteligencia artificial y la salud digital representan una oportunidad estratégica de alto impacto. Su implementación puede reducir brechas geográficas, optimizar recursos y mejorar la calidad del cuidado sin requerir necesariamente infraestructuras hospitalarias masivas. La clave reside en integrar estas tecnologías de manera ética, contextualizada y alineada con las necesidades reales de la población, formando profesionales capaces de dialogar con la tecnología sin perder el núcleo humanista de la medicina.
En síntesis, la inteligencia artificial y la salud digital no constituyen una moda tecnológica, sino el cimiento de una nueva arquitectura del cuidado, donde la información fluye de manera continua, las decisiones se apoyan en evidencia dinámica y el paciente ocupa un rol activo en la gestión de su propia salud. En este nuevo paradigma, la tecnología no sustituye la relación médica, sino que la potencia, permitiendo una medicina más precisa, preventiva y profundamente humana.
5.- Prevención, epigenética y longevidad: gestionar la trayectoria vital. En las últimas dos décadas, la medicina ha comenzado a experimentar un cambio silencioso pero profundo: el desplazamiento desde una lógica centrada en el tratamiento de la enfermedad hacia una gestión activa de la trayectoria vital del individuo. Este giro ha sido impulsado por los avances en epigenética, biología del envejecimiento y medicina preventiva avanzada, que han demostrado que el destino biológico no está determinado de forma rígida por el genoma, sino que es modulable a lo largo de la vida mediante intervenciones específicas, medibles y, en muchos casos, reversibles.
La epigenética —el estudio de los mecanismos que regulan la expresión génica sin alterar la secuencia del ADN— ha sido central en esta transformación conceptual. Modificaciones como la metilación del ADN, los cambios en histonas y la acción de microARN responden de manera dinámica a factores ambientales, nutricionales, metabólicos y psicosociales. Estudios poblacionales y experimentales han demostrado que estos mecanismos influyen de forma decisiva en el desarrollo de enfermedades cardiovasculares, cáncer, diabetes, patologías neurodegenerativas y procesos inflamatorios crónicos. En este contexto, la prevención deja de ser una recomendación general y se convierte en una estrategia personalizada basada en biología medible.
Uno de los avances más influyentes en este campo ha sido el desarrollo de los relojes epigenéticos, herramientas capaces de estimar la edad biológica de un individuo a partir de patrones de metilación del ADN. Investigadores como Steve Horvath y posteriormente David Sinclair han demostrado que la edad biológica puede diferir significativamente de la edad cronológica, y que esta diferencia se asocia con riesgo de enfermedad, fragilidad y mortalidad. Más aún, estudios recientes sugieren que la edad epigenética puede ralentizarse e incluso revertirse parcialmente mediante intervenciones específicas, abriendo un nuevo horizonte para la medicina preventiva y la longevidad.
El trabajo del Dr. David Sinclair, genetista de la Escuela de Medicina de Harvard, ha sido particularmente influyente al proponer que el envejecimiento no es solo un proceso de desgaste pasivo, sino una pérdida progresiva de información epigenética. Según este modelo, las células envejecen porque olvidan su identidad funcional original, lo que conduce a disfunción tisular y enfermedad. Experimentos en modelos animales han demostrado que la activación controlada de factores de reprogramación epigenética —similares a los descritos por Yamanaka— puede restaurar funciones juveniles en tejidos envejecidos sin perder identidad celular, un concepto que redefine radicalmente la noción de envejecimiento como un proceso potencialmente modificable.
En paralelo, la gerociencia ha identificado vías moleculares clave asociadas al envejecimiento, como la señalización de mTOR, AMPK, sirtuinas, NAD⁺ y la inflamación crónica de bajo grado (“inflammaging”). Intervenciones dirigidas a estas vías han mostrado resultados prometedores tanto en modelos animales como en estudios clínicos. El uso de metformina, por ejemplo, ha sido asociado con reducción de mortalidad y menor incidencia de cáncer y enfermedades cardiovasculares en poblaciones diabéticas, lo que ha dado origen al ensayo clínico TAME (Targeting Aging with Metformin), uno de los primeros estudios diseñados explícitamente para evaluar el envejecimiento como un objetivo terapéutico.
Asimismo, el interés por senolíticos —fármacos capaces de eliminar células senescentes— ha crecido de manera exponencial. Estudios liderados por investigadores como James Kirkland (Mayo Clinic) han demostrado que la eliminación selectiva de células senescentes mejora la función tisular, reduce la inflamación y prolonga la salud en modelos animales. Ensayos clínicos iniciales en humanos sugieren beneficios potenciales en enfermedades asociadas al envejecimiento, como fibrosis pulmonar, osteoartritis y fragilidad.
Un componente fundamental en la comprensión moderna del envejecimiento biológico es la investigación sobre los telómeros, estructuras repetitivas que protegen los extremos de los cromosomas y cuya longitud se acorta progresivamente con cada división celular. Desde los trabajos pioneros de Elizabeth Blackburn, Carol Greider y Jack Szostak, galardonados con el Premio Nobel de Medicina, se ha establecido que el acortamiento telomérico no es solo un marcador pasivo del envejecimiento, sino un proceso activamente implicado en la senescencia celular, la inestabilidad genómica y el desarrollo de enfermedades crónicas. Estudios clínicos han demostrado asociaciones consistentes entre telómeros cortos y mayor riesgo de enfermedades cardiovasculares, cáncer, diabetes tipo 2 y deterioro cognitivo, así como una reducción en la expectativa de vida saludable. Más aún, investigaciones recientes sugieren que la longitud telomérica puede ser influenciada por factores modificables, como el estrés crónico, la inflamación, el estilo de vida, la actividad física y ciertos patrones nutricionales, conectando de manera directa la biología molecular con la prevención clínica. En este contexto, los telómeros se han transformado en un biomarcador integrador de envejecimiento sistémico, reforzando la idea de que la trayectoria vital no está predeterminada de forma rígida, sino que puede ser modulada mediante intervenciones tempranas y sostenidas. Así, el estudio de los telómeros no solo aporta una herramienta diagnóstica y pronóstica, sino que consolida una visión de la longevidad como un proceso dinámico, influido por la interacción continua entre genética, epigenética y entorno.
La prevención avanzada también ha incorporado tecnologías emergentes que permiten monitorizar y modular la biología en tiempo real. La integración de biomarcadores epigenéticos, metabolómicos y digitales —a través de dispositivos portátiles— permite evaluar el impacto de intervenciones como nutrición personalizada, ejercicio físico, ayuno intermitente, restricción calórica o manejo del estrés sobre la biología individual. En este marco, la longevidad deja de ser un concepto abstracto y se convierte en un proyecto clínico medible y ajustable.
En el ámbito neurológico, estos enfoques han comenzado a aplicarse a la prevención del deterioro cognitivo y las enfermedades neurodegenerativas. Estudios longitudinales han demostrado que intervenciones multimodales que combinan dieta, actividad física, estimulación cognitiva y control metabólico pueden ralentizar o revertir el deterioro cognitivo leve, especialmente cuando se implementan en etapas tempranas. La epigenética emerge aquí como un puente entre estilo de vida, inflamación, metabolismo cerebral y función cognitiva.
Desde una perspectiva más amplia, la medicina de la longevidad redefine la relación entre salud pública y biomedicina. En lugar de esperar la aparición de enfermedades crónicas, propone gestionar activamente la trayectoria biológica desde etapas tempranas, reduciendo la carga futura sobre los sistemas de salud y mejorando la calidad de vida de las poblaciones envejecidas. Para países como Chile, que enfrentan un rápido envejecimiento demográfico, esta aproximación no es solo innovadora, sino estratégicamente imprescindible.
En síntesis, la convergencia entre prevención, epigenética y longevidad inaugura un nuevo paradigma médico: el paso desde una medicina centrada en la enfermedad hacia una medicina orientada a preservar la funcionalidad, la autonomía y la coherencia biológica a lo largo del tiempo. Lejos de prometer una inmortalidad ilusoria, este enfoque propone algo más profundo y alcanzable: extender los años de vida saludable, gestionando el envejecimiento como un proceso biológico dinámico, susceptible de intervención racional, ética y basada en evidencia.
Otro cambio fundamental ha sido la revalorización de la prevención como eje central de la medicina moderna. La comprensión de los mecanismos epigenéticos ha demostrado que una parte significativa del riesgo de enfermedad depende de factores modificables: alimentación, estrés, actividad física, sueño, entorno y vínculos sociales.
La aparición de relojes epigenéticos, biomarcadores tempranos y modelos predictivos ha permitido cuantificar el envejecimiento biológico y diseñar intervenciones orientadas a prolongar la salud, más que la vida cronológica. La gerociencia emerge así como un campo estratégico para los sistemas de salud del futuro.
Para Chile, país que envejece aceleradamente, esta perspectiva no es solo deseable, sino urgente. La innovación biomédica aplicada a la prevención puede reducir costos sanitarios, mejorar calidad de vida y fortalecer el tejido social.
6.- Biofísica, medicina informacional y nuevas fronteras conceptuales. En los márgenes —y progresivamente más cerca del centro— del pensamiento biomédico contemporáneo, emerge un conjunto de enfoques que proponen una ampliación del marco clásico con el que se ha comprendido la biología y la medicina. Estos enfoques, agrupados bajo conceptos como biofísica médica, medicina informacional y regulación energética, parten de una premisa fundamental: los sistemas vivos no pueden explicarse únicamente como agregados de reacciones bioquímicas, sino que funcionan también como sistemas organizados de información, energía y coherencia.
Desde una perspectiva estrictamente científica, la biofísica ha aportado evidencia sólida de que múltiples procesos biológicos dependen de gradientes eléctricos, campos electromagnéticos, oscilaciones y resonancias. La bioelectricidad celular, por ejemplo, desempeña un rol crucial en la morfogénesis, la regeneración tisular y la cicatrización, como lo demuestran estudios sobre potenciales de membrana, señales iónicas y campos endógenos que guían la organización celular. Investigaciones en desarrollo embrionario y regeneración han mostrado que patrones bioeléctricos preceden y condicionan la expresión génica, sugiriendo que la información biológica no fluye exclusivamente desde el ADN hacia la función, sino que existe una regulación jerárquica multinivel.
En este contexto, tecnologías como la fotobiomodulación, los campos electromagnéticos pulsados (PEMF) y otras formas de estimulación biofísica han comenzado a encontrar aplicaciones clínicas con respaldo experimental creciente. Estos enfoques no actúan introduciendo moléculas externas, sino modulando procesos celulares a través de señales físicas que influyen en la función mitocondrial, la señalización intracelular y la expresión génica. Aunque su integración plena en la medicina convencional aún está en desarrollo, representan una ampliación legítima del arsenal terapéutico desde una lógica regulatoria más que sustitutiva.
La medicina biofotónica constituye una de las expresiones más avanzadas de la convergencia entre física, biología y medicina, y se basa en el estudio y la aplicación de la interacción entre la luz y los sistemas biológicos. En términos fundamentales, la biofotónica utiliza fotones —desde el ultravioleta hasta el infrarrojo cercano— para detectar, caracterizar y modular procesos biológicos con alta sensibilidad y mínima invasividad. En la práctica clínica actual, su mayor desarrollo se encuentra en el ámbito diagnóstico: técnicas como la espectroscopía óptica, la imagen por fluorescencia, la tomografía de coherencia óptica (OCT) y la microscopía avanzada permiten identificar cambios moleculares, metabólicos y estructurales en tejidos vivos mucho antes de que sean visibles por métodos convencionales. Estas herramientas se utilizan hoy en oncología para detección precoz de lesiones, en oftalmología para evaluar capas retinianas, en dermatología para diferenciar tejidos benignos y malignos, y en investigación biomédica para estudiar dinámicas celulares en tiempo real. Más allá del diagnóstico, la biofotónica se proyecta como una plataforma clave para la medicina del futuro, integrando sensores ópticos inteligentes, biomarcadores fotónicos y sistemas de análisis asistidos por inteligencia artificial. En este horizonte, la luz no solo permitirá observar la biología, sino también interactuar con ella de manera precisa, guiando terapias personalizadas, monitoreando respuestas en tiempo real y contribuyendo a una medicina cada vez más temprana, informacional y mínimamente invasiva.
Desde el punto de vista clínico, la medicina biofotónica ha comenzado a consolidarse también como una herramienta terapéutica y moduladora, particularmente a través de la fotobiomodulación y otras aplicaciones de la luz de baja intensidad. Estas intervenciones utilizan longitudes de onda específicas para influir en procesos celulares como la función mitocondrial, la producción de ATP, la señalización redox y la modulación de la inflamación, sin inducir daño térmico. En la práctica clínica actual, la biofotónica se emplea como terapia adyuvante en la cicatrización de heridas, la regeneración tisular, el manejo del dolor, la recuperación neurológica y la reducción de efectos adversos asociados a tratamientos oncológicos. Estudios experimentales y clínicos sugieren que la luz puede actuar como un regulador biofísico, capaz de optimizar la respuesta de los tejidos a procesos reparativos y terapias convencionales. A futuro, se proyecta que estas tecnologías evolucionen hacia sistemas de fototerapia personalizada, guiados por biomarcadores ópticos y algoritmos de inteligencia artificial, permitiendo ajustar parámetros de luz en tiempo real según la respuesta biológica individual. En este escenario, la biofotónica se perfila no solo como una modalidad terapéutica complementaria, sino como un componente integral de una medicina más precisa, regenerativa y centrada en la modulación inteligente de los procesos biológicos.
A partir de estas bases, surge el concepto de medicina informacional, que propone que la salud y la enfermedad pueden entenderse, en parte, como estados de orden o desorden en los flujos de información biológica. En este marco, la enfermedad no sería solo una alteración estructural o bioquímica, sino una pérdida de coherencia en los sistemas de comunicación celular, tisular y sistémica. Esta idea dialoga con modelos de sistemas complejos, teoría del caos y biología de redes, donde pequeñas perturbaciones informacionales pueden producir efectos macroscópicos significativos.
Es en este territorio de frontera donde aparecen conceptos más controvertidos, pero intelectualmente estimulantes, como la llamada medicina cuántica. Es importante subrayar que este término no corresponde a una disciplina clínica consolidada, sino a un conjunto heterogéneo de hipótesis y modelos teóricos que exploran si ciertos procesos biológicos podrían implicar fenómenos cuánticos no triviales. La mayoría de la práctica médica no requiere invocar la mecánica cuántica para su explicación; sin embargo, algunos investigadores sostienen que ciertos niveles de organización biológica podrían no explicarse completamente desde la física clásica.
A partir de aquí surge el concepto de medicina informacional, que propone entender la salud como un estado de coherencia dinámica en los sistemas de comunicación biológica. En este marco, la enfermedad puede interpretarse no solo como una lesión estructural o una alteración bioquímica, sino como una pérdida de orden informacional, donde las señales que coordinan la función celular y tisular se vuelven caóticas o incoherentes. Esta idea encuentra resonancia en la biología de sistemas, la teoría de redes y la física de sistemas complejos, donde pequeñas perturbaciones informacionales pueden generar efectos macroscópicos profundos.
Es en este punto donde el término “medicina cuántica” aparece con mayor frecuencia, y donde se vuelve imprescindible ejercer una distinción conceptual rigurosa. En su acepción científica estricta, la biología cuántica estudia aquellos procesos biológicos en los que fenómenos cuánticos —como el túnel de protones, la coherencia o las reacciones dependientes del espín— desempeñan un rol funcional demostrable. Existen ejemplos sólidos enzimáticos y bioquímicos que muestran que la mecánica cuántica no es irrelevante para la vida, sino que puede conferir eficiencia y selectividad a procesos fundamentales. En este sentido, lo “cuántico” no es una metáfora, sino una herramienta explicativa concreta en niveles muy específicos de la biología.
En este contexto se inscribe la teoría Orch-OR (Orchestrated Objective Reduction) propuesta por Stuart Hameroff y Roger Penrose, que sugiere que la conciencia podría emerger de procesos cuánticos coherentes en los microtúbulos del citoesqueleto neuronal. Según este modelo, los microtúbulos no serían meros elementos estructurales, sino potenciales procesadores de información cuántica a escala subneuronal. Si bien esta teoría ha sido objeto de críticas significativas —especialmente respecto a la decoherencia cuántica en sistemas biológicos a temperatura corporal—, también ha estimulado investigaciones experimentales sobre propiedades eléctricas, vibracionales y resonantes de los microtúbulos. Aunque lejos de estar demostrada, esta línea de pensamiento ha contribuido a abrir un debate legítimo sobre los límites actuales del reduccionismo neurobiológico.
Otro conjunto de ideas altamente especulativas, pero influyentes en ciertos círculos de investigación, proviene del trabajo del Dr. Peter Gariaev y su propuesta de la genética ondulatoria. Gariaev postuló que el ADN no actúa únicamente como un código químico lineal, sino también como un sistema capaz de emitir y recibir señales electromagnéticas y fotónicas, participando en procesos de comunicación bioinformacional. Dentro de este marco surge el concepto del llamado “ADN fantasma” y la reinterpretación del llamado “ADN basura”, hoy ampliamente reconocido como ADN no codificante con funciones regulatorias complejas. Si bien muchas de las afirmaciones de Gariaev no han sido validadas por la biología molecular convencional y permanecen fuera del consenso científico, su trabajo anticipó, de manera intuitiva, la creciente importancia que hoy se reconoce al ADN no codificante, a la regulación epigenética y a las dinámicas tridimensionales del genoma.
La denominada teoría de las ondas lingüísticas, asociada a esta corriente, propone que el ADN respondería a patrones informacionales complejos más allá de la secuencia nucleotídica, una idea que hoy puede reinterpretarse, con mayor rigor, a la luz de los descubrimientos sobre arquitectura cromosómica, bucles regulatorios, ARN no codificante y control epigenético. Aunque el lenguaje utilizado por estas teorías excede el marco científico actual, su valor histórico reside en haber cuestionado tempranamente la noción reduccionista del gen como unidad aislada de información.
Es fundamental señalar que la ciencia progresa precisamente explorando estos límites, sometiendo hipótesis audaces a contrastación rigurosa y descartando aquellas que no superan el escrutinio experimental. Muchas ideas que hoy forman parte del núcleo de la biomedicina —desde la epigenética hasta la plasticidad neuronal— fueron inicialmente consideradas marginales o especulativas. En este sentido, el estudio de la biofísica avanzada, la coherencia biológica y los modelos informacionales no debe entenderse como una negación de la medicina basada en evidencia, sino como una extensión exploratoria de sus fronteras conceptuales.
Para la medicina del futuro, el desafío no será adoptar acríticamente estas teorías, sino integrar lo que resulte validable, manteniendo una actitud abierta, crítica y metodológicamente sólida. En la medida en que se logre traducir estos conceptos en modelos experimentales reproducibles y aplicaciones clínicas seguras, la biofísica y la medicina informacional podrían contribuir a una comprensión más profunda de la salud como un estado de equilibrio dinámico entre materia, energía e información.
En síntesis, este conjunto de aproximaciones representa una zona fértil de exploración intelectual, donde convergen biología, física, neurociencia y filosofía de la mente. Aunque muchas de sus hipótesis permanecen en el terreno de la especulación, su valor radica en desafiar los límites actuales del conocimiento y en recordarnos que la ciencia, para seguir avanzando, debe atreverse a formular preguntas que aún no tienen respuesta. En ese espíritu, la medicina informacional no se presenta como una alternativa a la biomedicina contemporánea, sino como un horizonte posible, cuya exploración responsable podría enriquecer la comprensión integral del fenómeno vital.
Si bien este campo requiere aún mayor validación clínica, representa una frontera conceptual relevante: la transición desde una medicina exclusivamente material hacia una medicina de la información, donde la regulación precede a la estructura y la función emerge de la coherencia.
Chile, con su tradición científica sólida y su flexibilidad relativa, podría convertirse en un espacio privilegiado para la investigación clínica responsable de estas nuevas aproximaciones.
Conclusión
La innovación biomédica de los últimos quince años ha transformado la medicina de manera profunda e irreversible. Hemos transitado desde una práctica reactiva y estandarizada hacia una medicina predictiva, personalizada, preventiva y participativa. La convergencia entre biología, tecnología, información e inteligencia redefine no solo cómo tratamos las enfermedades, sino cómo entendemos la salud y la vida. Para Chile, el desafío no es simplemente adoptar estas innovaciones, sino integrarlas con visión estratégica, desarrollando capacidades locales, formando profesionales del futuro y construyendo un modelo de salud que combine ciencia de frontera, ética y humanismo. En ese camino, la innovación deja de ser un fin en sí mismo y se convierte en una herramienta para el bienestar individual y colectivo









